
نقش نانوپزشکی و هوش مصنوعی در درمان سرطان
سرطان همچنان یکی از مرگبارترین بیماریهای جهان است که بهطور قابلتوجهی، کیفیت زندگی بیماران را تحتتأثیر قرار میدهد. برای مقابله با افزایش مرگومیر ناشی از سرطان، رویکردهای نوآورانهای مانند نانوپزشکی و هوش مصنوعی ضروری هستند. همافزایی نانوپزشکی و هوش مصنوعی، افقی تحولآفرین در مراقبتهای بهداشتی سرطان ایجاد کرده و نویدبخش پیشرفتهای بیسابقهای در تشخیص، درمان و مدیریت بیماران است. این مطالعه کاربردهای نانوپزشکی و هوش مصنوعی را در سرطانشناسی و همچنین ظرفیت همافزایی آنها را بررسی میکند.
سرطان همچنان یکی از علل اصلی مرگومیر در جهان است و در کیفیت زندگی بیماران، تأثیر عمیقی دارد. افزایش بار جهانی سرطان، نیازمند رویکردهای نوآورانه برای بهبود تشخیص، پیشگیری و درمان است. پیشرفتهای اخیر در نانوپزشکی، راهحلهای امیدوارکنندهای را از طریق توسعة پلتفرمهای درمانی نوین ارائه داده است. نانوذرات مانند نانوذرات آلبومین، لیپوزومها و میسلهای پلیمری، بهدلیل ویژگیهای منحصربهفرد خود، ازجمله قطر کوچک، اتصال مؤثر، قابلیت هدفگیری و کاهش سمیت، ظرفیت قابلتوجهی نشان دادهاند.
نانوپزشکی برای تحویل هدفمند دارو، از نانوذرات استفاده میکند، اثربخشی درمانی را افزایش میدهد و عوارض جانبی را به حداقل میرساند. در عین حال، الگوریتمهای هوش مصنوعی تشخیص زودهنگام سرطان، برنامهریزی درمانی شخصیسازیشده و تحلیلهای پیشبینیکننده را تسهیل و نتایج بالینی را بهینه میکنند. ادغام نوظهور این فناوریها میتواند مراقبت از سرطان را با تسهیل راهبردهای درمانی دقیق، شخصیسازیشده و تطبیقی، متحول کند.
در سال 2020، حدود 3/19 میلیون مورد جدید سرطان و نزدیک به ده میلیون مرگ مرتبط با سرطان در جهان گزارش شد. با شناسایی بیش از دویست نوع بدخیم، پیشبینی میشود که سرطان تا سال 2030، به اصلیترین علت مرگ تبدیل شود. دادههای سازمان بهداشت جهانی و آژانس بینالمللی تحقیقات سرطان پیشبینی میکنند که تا سال 2050، موارد سرطان در جهان 77 درصد افزایش یابد؛ از حدود 20 میلیون در سال 2022، به بیش از 35 میلیون. انتظار میرود این افزایش، به دوبرابرشدن مرگهای ناشی از سرطان تا سال 2050 منجر شود؛ با تخمین 5/18 میلیون مرگ در مقایسه با 7/9 میلیون در سال 2022.
انتظار میرود آفریقا بیشترین افزایش در موارد سرطان را تا سال 2050 داشته باشد، با افزایش تقریبی 140 درصد، از 2/1 میلیون مورد در سال 2022 به 8/2 میلیون. پیشبینی میشود در آسیا، که در سال 2022 با بیش از 8/9 میلیون مورد، بالاترین تعداد موارد سرطان را در جهان داشت، تا سال 2050، با افزایش 77 درصد، موارد ابتلا به سرطان به 4/17 میلیون نفر برسد.
ادغام هوش مصنوعی در تشخیص و درمان سرطان، پیشرفت چشمگیری در مبارزه با این بیماری ایجاد کرده است. فناوریهای هوش مصنوعی میتوانند با افزایش دقت و سرعت تشخیص، شخصیسازی برنامههای درمانی و پیشبینی نتایج بیماران، نحوة تشخیص و درمان سرطان را بهطور چشمگیری بهبود بخشند. با تجزیهوتحلیل مجموعههای دادة عظیم، هوش مصنوعی میتواند الگوهایی را شناسایی کند که فراتر از تواناییهای انسانی هستند و امکان تشخیص زودهنگام و گزینههای درمانی شخصیسازیشده و مؤثرتر را فراهم آورند.
در حوزة نانوپزشکی، هوش مصنوعی برای بهینهسازی طراحی و تحویل درمانهای مبتنیبر نانوذرات ضروری است. الگوریتمهای یادگیری ماشین به پژوهشگران امکان میدهند تا تعاملات نانوذرات با سیستمهای بیولوژیکی را پیشبینی کنند، قابلیتهای هدفگیری را بهبود بخشند و عوارض جانبی احتمالی را کاهش دهند. مدلهای مبتنیبر هوش مصنوعی، میتوانند با شناسایی سریعتر ترکیبات و فرمولاسیونهای نویدبخش در مقایسه با روشهای سنتی، توسعة نانوداروهای جدید را تسریع کنند.
نانوفناوری در سرطانشناسی، که به آن نانوسرطانشناسی نیز گفته میشود، شامل استفاده از عوامل دارویی در مقیاس نانو بهعنوان درمانهای ضدسرطان است. این رویکرد نوظهور طی دو دهة گذشته، نتایج امیدوارکنندهای در زمینههای تشخیص، درمان و پیشگیری از سرطان نشان داده است و بهعنوان یکی از روشهای پیشرفته و نوین در علم سرطانشناسی شناخته میشود.
لیپوزومها
لیپوزومها که از فسفولیپیدهای طبیعی یا سنتزی مانند کلسترول ساخته میشوند، یکی از پلتفرمهای نانودرمانی تجاریسازیشده و مؤثر بهشمار میروند. این ساختارها توانایی کپسولهکردن داروهای محلول در آب و چربی را دارند و به همین دلیل، باعث افزایش حلالیت و پایداری عوامل درمانی میشوند. سازگاری زیستی و قابلیت تجزیهپذیری آنها، لیپوزومها را بهگزینهای مناسب برای درمانهای هدفمند تبدیل کرده است که در نهایت، به کاهش سمیت سیستمیک مرتبط با شیمیدرمانی سنتی منجر میشود.
ازجمله مزایای لیپوزومها میتوان به افزایش زمان گردش در بدن و هدفگیری غیرفعال تومورها از طریق اثر افزایش نفوذپذیری و نگهداشت اشاره کرد. آنها همچنین باعث افزایش حلالیت دارو و رهایش آهسته و پایدار دارو میشوند که این موارد درمجموع، به کاهش سمیت عمومی داروهای آزاد کمک میکنند. در همین زمینه، برخی پژوهشها استفاده از لیپوزومها را برای غلبه بر محدودیتهای فارماکوکینتیکی و افزایش کارایی درمانی داروهای شیمیدرمانی بررسی کردهاند.
بااینحال، با وجود موفقیت لیپوزومها در درمان انواع مختلف سرطان، هنوز چالشهایی نظیر سمیت، هدفگیری ناکامل و پراکندگی نابههنجار در بدن وجود دارد که مانع از کاربرد گستردة بالینی آنها شده است. این موضوع نشاندهندة نیاز به تحقیقات بیشتر و هدفمند برای رفع این موانع است.
وزیکولهای خارج سلولی
وزیکولهای خارج سلولی (EVs) بهدلیل ترکیب بیولوژیکی منحصربهفرد و جذب سلولی مؤثر، قابلیت قابلتوجهی برای تحویل دارو ارائه میدهند. سطح این وزیکولها میتواند برای هدفگیری خاص نواحی توموری اصلاح شود، که آنها را بهویژه برای درمان سرطان مغز جذاب میکند؛ زیرا میتوانند بهطور طبیعی از سد خونی مغزی عبور کنند. علاوهبر این، EVها میتوانند طیف وسیعی از مولکولهای زیستفعال را منتقل کنند که برای تشخیص زودهنگام سرطان و ارزیابی مداوم بیماری مفیدند.
منشأ طبیعی و توانایی EVs در ارتباط سلولی، آنها را به انتخابی عالی برای پزشکی شخصیسازیشده و ایمونوتراپی تبدیل میکند. در پژوهشی، کاربردهای زیستپزشکی EVs خلاصه، و بر قابلیت آنها در تشخیص پیشرفتة سرطان از طریق بیوپسی مایع و بهعنوان حاملهای نوآورانه برای تحویل دارو، تأکید شده است. پژوهشگران دربارة کارایی تشخیصی EVs در چندین مطالعة بالینی مشاهدهای، ازجمله مطالعاتی راجعبه سرطان پانکراس یا آدنوکارسینوم مجرای پانکراس، متاستاز و کارسینوم سلول دهان و حلق، بحث کردهاند.
دندریمر
دندریمرها نانوحاملهای مصنوعی هستند که با ساختار درختی یا شاخهمانند خود، متشکل از زیرواحدهای متقارن شعاعی، مشخص میشوند. معماری بسیار شاخهدار و کاملاً تعریفشدة آنها، امکان عملکردیسازی سطحی و قابلیتهای هدفگیری عالی را فراهم میکند. این طراحی ساختاری منحصربهفرد، توانایی آنها را برای اتصال خاص به سلولهای سرطانی بهبود میبخشد و در نتیجه، رهاسازی هدفمند داروهای شیمیدرمانی به محلهای توموری را تقویت میکند و آسیب به بافتهای سالم را کاهش میدهد.
دندریمرها بهویژه برای درمان تومورهای مغزی نویدبخش هستند؛ زیرا میتوانند زنوبیوتیکها را از طریق سد خونی مغزی و هدفگیری مؤثر تومورهای مغزی، انتقال دهند. این نانوحاملها برای کاربردهای درمانی نوآورانه، ازجمله رهاسازی پایدار دارو، ایمونوتراپی و درمانهای مختلف ضدسرطان، درحال توسعهاند. برای مثال، دندریمرهای پلیآمیدوآمین (PAMAM)، پلیپروپیلنیمین، پلیاللایزین و دندریمرهای عملکردیسازیشده، پیشرفتهای قابلتوجهی در تشخیص و درمان تومورهای مغزی ایجاد کردهاند.
در پژوهشی، ساختار، ویژگیها و تولید تجاری دندریمرهای PAMAM بررسی شده است. کار پژوهشگران بر دندریمرهای PAMAM تجاری موجود، مانند Superfect® وPolyfect® ، متمرکز بود و بر کاربردهای تحویل داروی هدفمند آنها در داروسازی و دیگر استفادههای زیستپزشکی تأکید کردند. بااینحال، تولید انبوه دندریمرهای PAMAM با نسل بالا و بدون نقص، بهدلیل پیچیدگیهای فرایند خالصسازی و مدیریت دقیق پارامترهای انرژی، با چالشهایی مواجه است. شکل 1 انواع نانوذرات را نشان میدهد.
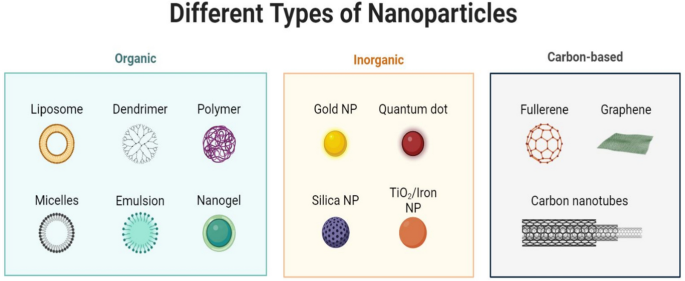
شکل 1. انواع نانوذرات
نانوذرات پلیمری
در درمان سرطان، نانوذرات پلیمری بهدلیل تواناییشان در بهبود مراقبت از بیماران از طریق رهاسازی دقیق و کنترلشدة عوامل درمانی، جایگاه ویژهای پیدا کردهاند. این نانوذرات میتوانند غلظت بهینة دارو را در محلهای توموری حفظ کنند و اثربخشی درمان را افزایش دهند. آنها بهدلیل زیستسازگاری و توانایی کپسولهکردن داروهای آبدوست و آبگریز، برای طیف وسیعی از درمانهای ضدسرطان مناسباند.
علاوهبر این، با عملکردیسازی نانوذرات، میتوان تحویل دقیق دارو را به سلولهای سرطانی محقق کرد. ترکیب نانوذرات پلیمری با مواد دیگر، میتواند ظرفیت درمانی آنها را بیشتر تقویت کند. برای مثال، آنها میتوانند با ترکیب اجزای غیرآلی مانند نانولولههای کربنی، پلیمرها، سیلیکا، نانوذرات اکسید فلزی و گرافن با ترکیبات آلی مانند لیپیدها، پروتئینها و فسفولیپیدها، سنتز شوند. این رویکرد هیبریدی در مقایسه با فرمولاسیونهای دارویی سنتی، مزایای قابلتوجهی ارائه میدهد.
پژوهشگران در یکی از تحقیقات خود، توسعة نانوذرات هیبریدی پلیمری را برای کاربردهای زیستپزشکی مرور کردند و روشهای سنتز پیشرفته و کاربردهای آنها را در محیطهای آزمایشگاهی و حیوانی برجسته کردند. کار آنها بینشهای ارزشمندی دربارة جدیدترین روشها و کاربردهای عملی این نانوذرات برای بهبود راهبردهای درمانی ارائه میدهد.
یکی از نمونههای برجستة پلیمر چندمنظورة مورد استفاده در سنتز نانوذرات، پلی لاکتیک کوـ گلیکولیک اسید است. این کوپلیمرزیستتخریبپذیر، متشکل از اسیدلاکتیک و گلیکولیک، بهدلیل ظرفیتی که در افزایش اثربخشی درمانی دارد، مورد توجه قرار گرفته است. با تأییدیة سازمان غذا و داروی آمریکا برای فرمولاسیونهای رهاسازی طولانیمدت، PLGA بهطور گسترده برای کپسولهکردن داروهای ضدسرطان استفاده میشود؛ زیرا سمیت سیستمیک را کاهش میدهد. فرمولاسیونهای بالینی مانند Decapeptyl، Suprecur MP و Lupron Depot کاربرد موفق آن را در درمان سرطان نشان میدهند.
در پژوهشی دیگر، روشهای مختلف ساخت فرمولهای مبتنیبر PLGA و سیستمهای تحویل دارو بررسی شد و عوامل مؤثر بر تخریب و پروفایلهای رهاسازی دارو تحت مطالعه قرار گرفت. بررسی این پیشرفتها راههای جدیدی برای بهبود روشهای درمان سرطان باز میکند.
نقاط کوانتومی
نقاط کوانتومی نانوذرات نیمهرسانا بهاندازهای بین ۲ تا ۱۰ نانومتر هستند که بهدلیل خواص نوری و الکترونیکی استثنایی خود، برای پیشرفت در تشخیص و درمان سرطان حیاتی هستند. نقاط کوانتومی امکان استفاده از روشهای تصویربرداری با حساسیت بالا را فراهم و تشخیص زودهنگام و پایش رشد تومور را تسهیل میکنند. علاوهبر این، نقاط کوانتومی میتوانند بهعنوان حاملهایی برای تحویل دقیق عوامل درمانی به محل سرطان، عمل کنند و تأثیر در بافتهای سالم اطراف را بهطور چشمگیری کاهش دهند.
در فتودینامیکتراپی، نقاط کوانتومی با فعالسازی توسط نور، گونههای فعال اکسیژن تولید میکنند و بهصورت انتخابی، سلولهای سرطانی را از بین میبرند. پس از تأیید اولین آزمایش بالینی انسانی برای فناوری نقاط کوانتومی توسط سازمان غذا و داروی آمریکا در سال ۲۰۱۱، پیشرفتهای مداومی در این زمینه حاصل شده است. این سازمان بهتازگی، یک آزمایش بالینی را برای نقاط کورنل (C-dots) در درمان ملانوما نیز تأیید کرده است. نقاط کوانتومی کربنی (CQDs)، زیرمجموعهای از نقاط کوانتومی، بهعنوان نانومواد مهمی در خانوادة کربن درحال ظهور هستند.
پژوهشگران نقاط کوانتومی کربنی دوپشده با مس (Cu-CQDs) را با استفاده از روش سنتز هیدروترمال تکمرحلهای توسعه دادند. یافتههای آنها نشان داد کهCu-CQD ها نهتنها ایمنی زیستی چشمگیری دارند، بلکه خواص ضدسرطانی قابلتوجهی نیز دارند و بهطور مؤثری ماهیت بدخیم را مختل و هموستاز اکسیداتیو را در سلولهای سرطان سینه حفظ میکنند. بهطور کلی، این راهبردهای مبتنیبر نانوذرات، در خط مقدم سرطانشناسی دقیق قرار دارند و در مقایسه با درمانهای مرسوم سرطان، جایگزینهایی هدفمند، مؤثر و ایمنتر ارائه میدهند.
هوش مصنوعی پیشرفته
بهروزرسانیهای کنترلنشده و سوءاستفاده توسط دولتهای سرکش یا شرکتهای غیراخلاقی، میتواند به نقض حریم خصوصی، هک شدن و دستکاری غیراخلاقی منجر شود که سود را بر منافع عمومی ترجیح میدهند. هوش مصنوعی پیشرفته با پیشیگرفتن از هوش انسانی در محاسبات و تصمیمگیری، مراقبتهای بهداشتی را با تحلیل دادههای پزشکی عظیم برای تشخیصهای برتر، برنامههای درمانی و نظارت بر بیماران متحول میکند. قدرت پیشبینی آن، مراقبتهای بهداشتی را از حالت واکنشی به پیشفعال تغییر میدهد و خطرهای سلامتی و شیوع بیماریها را زودتر شناسایی میکند. برای مثال، میتواند کارسینوژنز را از روند دادههای بیمار پیشبینی کند و امکان اقدامات پیشگیرانة مؤثر و استفادة بهینه از منابع را فراهم کند.
هوش مصنوعی پیشرفته از طریق نظارت بلادرنگ بر دستگاههای پزشکی، با تشخیص زودهنگام رویدادهای نامطلوب، مانند سمیت دارویی یا عوارض جراحی و هشدار به ارائهدهندگان برای مداخلة بهموقع، حفاظت از بیماران را تقویت میکند. چالشها شامل حریم خصوصی دادهها، نگرانیهای اخلاقی و خطاهای احتمالی است، اما مقررات قوی و مکانیزمهای ایمن میتوانند این خطرها را کاهش دهند و عملکرد قابلاعتماد هوش مصنوعی پیشرفته را تضمین کنند.
غول فناوری چندملیتی انویدیا در نوامبر ۲۰۲۰ اعلام کرد که قصد دارد نوعی ابررایانة هوش مصنوعی برای مطالعات مراقبتهای بهداشتی و تحویل دارو بسازد. هوش مصنوعی در مراقبتهای بهداشتی به شناسایی اهداف درمانی، کشف تعاملات پیچیدة پروتئینی و حل مشکلات بیولوژیکی پیچیده کمک میکند. همچنین، هوش مصنوعی روشهای تصویربرداری پزشکی پیشرفتهای ارائه میدهد که با تشخیص تغییرات سلولی غیرطبیعی، دقت تشخیص سرطان را بهبود میبخشد.
هوش مصنوعی در پزشکی، میتواند به نقشهبرداری اهداف درمانی، تفسیر تعاملات پیچیدة پروتئینی و پاسخ به سؤالات فیزیولوژیکی چالشبرانگیز کمک کند. برای مثال، سرویس سلامت ملی در اسکاتلند آزمایشی بالینی انجام میدهد تا از طریق تلفن، به افراد برای مشکلات پزشکی جزئی در خانه کمک کند. بهطور مشابه، بیماران برای شناسایی علائم و دریافت توصیههایی برای اقدامات بعدی در تنظیمات مراقبتهای اولیه و اجتماعی، از چتباتهای هوش مصنوعی استفاده میکنند.
بابیلون هلث و آدا نمونههای برجستهای از پلتفرمهای مراقبتهای بهداشتی آنلاین هستند که برای ارائة خدمات سلامت دیجیتال، با هدف بهبود نتایج بالینی، از فناوری هوش مصنوعی استفاده میکنند. این پلتفرمها برای ارائة مشاورة پزشکی اولیه، پیشنهاد مراحل بعدی برای تشخیص یا درمان و حمایت از تشخیص زودهنگام بیماری، از الگوریتمهای پیچیده کمک میگیرند.
با گسترش نقش هوش مصنوعی و یادگیری ماشین در مراقبت از سرطان، ایجاد گراف دادهای پیوندی بالینی نمونهای از پیشرفت عمده در ادغام مجموعههای دادههای زیستپزشکی متنوع برای پیشبرد تحقیقات و بهبود مراقبت از بیماران است. درواقعLDG دادههای ناهمگن از منابع مختلف مانند سوابق پزشکی، نتایج آزمایشهای بالینی و دادههای بیوشیمیایی را در ساختار یکپارچهای سازماندهی میکند. LDG مجموعة وسیعی از منابع بیوانفورماتیک را به هم متصل، و فرایندهای هوش مصنوعی و یادگیری ماشین را در مقیاس بزرگ، برای کشف درمانهای جدید سرطان و تقویت قابلیتهای تشخیصی تسهیل میکند.
این رویکرد نشاندهندة روند گستردهتری در تحقیقات سرطان است که در آن، روشهای تحلیل داده برای مواجهه با چالشهای پیچیده در درمان و تشخیص سرطان به کار گرفته میشود. برای مثال، مدلهای مبتنیبر هوش مصنوعی در LDG میتوانند پاسخ بیماران به درمانها را پیشبینی، یا اهداف دارویی جدیدی را شناسایی کنند.
نانوپزشکی در سرطان
نانوپزشکی در سرطان، برای شناسایی، پایش و مدیریت این بیماری، از فناوری نانو استفاده میکند و با ترکیب عوامل دارویی با فناوری در مقیاس نانو، پیشرفتهای قابلتوجهی را به ارمغان میآورد. این پیشرفتها میتوانند در ماشینآلات بیولوژیکی، نانوبیوسنسورها و تجهیزات پزشکی ادغام شوند و با حفظ دزهای درمانی هدفمند، نتایج درمانی را در بیماریهای پیچیده و مرگبار، بهطور قابلتوجهی بهبود بخشند.
سازمان غذا و داروی آمریکا چندین فرمولاسیون نانوپزشکی را برای درمان سرطان تأیید کرده است. نمونههای برجسته شامل Doxil،Myocet™ وDaunoXome هستند. سیستمهای تحویل داروی چندوجهی، پیشرفت چشمگیری در سرطانشناسی نشان میدهند؛ زیرا تحویل دارو را بهبود میبخشند، سمیت را کاهش میدهند و اثربخشی درمانی را افزایش میدهند. لیپوزومها و نانوذرات پوششدادهشده با لیگاند، میتوانند تحویل دارو به محلهای سرطانی را بهخوبی بهبود بخشند. پیشرفتهای اخیر بر نانوذراتی متمرکز شدهاند که قادرند همزمان، عوامل درمانی و تشخیصی را حمل کنند.
بحث و نتیجهگیری
ادغام هوش مصنوعی با نانوپزشکی، ظرفیت زیادی برای تحول در مراقبتهای سرطان دارد. هوش مصنوعی تشخیص زودهنگام را تسهیل و برنامههای درمانی را شخصیسازی میکند و توسعة نانوداروهای جدید را پیش میبرد، که برای مدیریت بار جهانی روبهرشد سرطان و بهبود نتایج بیماران حیاتی است.
در این مطلب، به انواع نانوذرات مورد استفاده در سرطانشناسی پرداختیم، محصولات بالقوة نانوسرطانشناسی را ارزیابی و نقش هوش مصنوعی در کاربردهای بالینی و سلامت دیجیتال را بررسی کردیم. همچنین، پیشرفتهای اخیر در سیستمهای تحویل دارو مبتنیبر نانو را برجسته کردیم که هدف آن ارائة دیدگاهی جامع از چگونگی تقویت درمان سرطان از طریق همافزایی نانوپزشکی و هوش مصنوعی است.
References
1. Samathoti, P., Kumarachari, R. (2025), “The Role of Nanomedicine and Artificial Intelligence in Cancer Health Care: Individual Applications and Emerging Integrations—A Narrative Review”, Discover Oncology, Vol. 16, Article Number 697.
2. Mukheja. Y., Pal, K. (2025), “Nanotechnology and Artificial Intelligence in Cancer Treatment”, Next Research, Vol. 2, Issue 1.
تهیهوتنظیم: دکتر ندا کفاش






